fluorin mewakili unsur kimia dengan nombor atom 9 dan tergolong dalam halogen. Ia adalah gas yang sangat menghakis, yang menyebabkan kerosakan teruk pada membran mukus. Fluorin digunakan secara perubatan dalam bentuk garamnya, fluorida, untuk menguatkan gigi.
Apa itu fluorin?
Fluor adalah gas yang sangat kaustik dan reaktif, bukan sebatian, tetapi unsur kimia yang tergolong dalam halogen. Dengan nombor atom 9 ia adalah halogen paling ringan. Secara semula jadi, fluorin berlaku terutamanya dalam bentuk garamnya, fluorida.
Fluor gas tidak terlalu stabil dan bertindak balas dengan hampir semua sebatian dan unsur sejurus selepas pengeluarannya. Hanya dengan gas helium dan neon mulia tidak ada reaksi. Kereaktifan yang sangat kuat ini dapat dijelaskan oleh pertaliannya yang sangat kuat dengan elektron. Ia selalu mengeluarkan elektron dari rakan tindak balasnya dan oleh itu agen pengoksidaan terkuat. Nama fluor berasal dari bahasa Latin "fluores" (sungai). Sebagai kalsium fluorida (fluorspar) ia berfungsi sebagai fluks untuk bijih.
Apabila fluorspar ditambahkan ke bijih, ia menurunkan titik leburnya sehingga menjadi lebih cepat cair. Dari sudut pandangan konseptual, dalam perubatan terdapat istilah genitalis fluorin untuk pengeluaran rembesan tanpa darah dari alat kelamin wanita. Walau bagaimanapun, fluorin genital tidak boleh dikelirukan dengan unsur fluorin.
Fungsi, kesan & tugas
Fluorin disebut unsur jejak penting. Walau bagaimanapun, kepentingan fluor adalah kontroversi. Telah diketahui bahawa fluorida mempunyai sifat pelindung terhadap gigi. Fluorida dapat menguatkan gigi dan pada masa yang sama menghalang enzim tertentu bakteria karies, yang menyebabkan pemecahan karbohidrat.
Fluorida bertindak secara langsung pada gigi. Pengambilan fluorida secara lisan tidak memberi kesan pada gigi. Gigi terdiri terutamanya daripada hidroksiapatit mineral. Hydroxyapatite boleh diserang oleh asid yang dihasilkan oleh pemecahan sisa makanan. Oleh itu, kebersihan gigi yang buruk sering mengakibatkan lubang pada gigi yang masih diserang oleh bakteria karies. Contohnya, jika ubat gigi mengandungi fluorida, terdapat pertukaran ion hidroksil dengan ion fluorida. Ini menghasilkan fluorapatit, yang ternyata menjadi bahan yang lebih keras dan kurang terdedah kepada asid. Bahkan hidroksiapatit yang dilarutkan oleh asid dapat diendapkan lagi sebagai fluoroapatit di hadapan fluorida.
Kehancuran awal dapat dibalikkan. Tetapi fluorida juga mempunyai sifat positif untuk membina tulang. Di sini pengambilannya berlaku secara lisan. Kanak-kanak dan bayi diberi fluorida dan vitamin D untuk mencegah riket. Walau bagaimanapun, fluorida tidak boleh berlebihan, sehingga fluorosis dengan kekakuan dan penebalan sendi tidak dapat berkembang. Sebatian fluorin juga disetujui sebagai ubat untuk osteoporosis. Tablet yang sesuai mengandungi natrium fluorida atau disodium fluorofosfat.
Pendidikan, kejadian, sifat & nilai optimum
Fluorin terkandung dalam bentuk fluorida dalam teh hitam dan hijau, asparagus dan juga pada ikan. Banyak garam mengandungi fluorida. Tidak ada garam fluorin tulen kerana kelarutan rendah sebatian yang mengandungi fluorida di dalam air. Fluorspar (kalsium fluorida) dan fluorapatit paling biasa di kerak bumi.
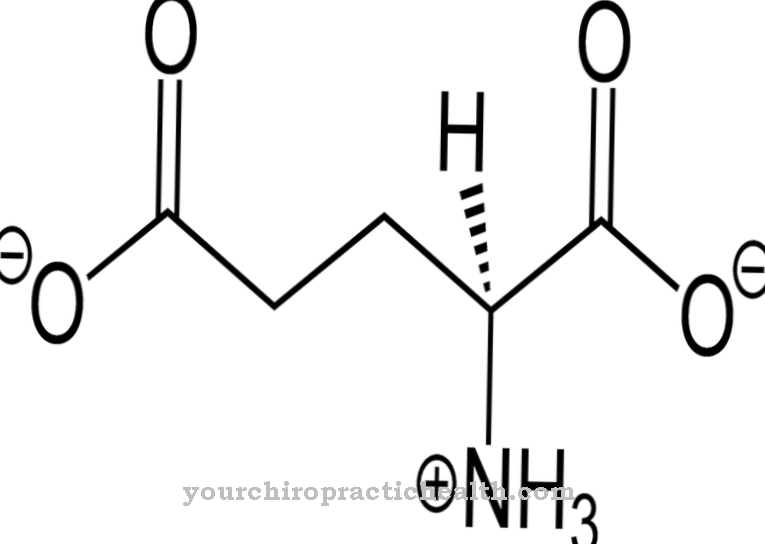
Fluorin terutama dibuat dari kalsium fluorida. Bahkan ada organisma yang boleh membuat sebatian organofluorin. Gifblaar Afrika Selatan atau tumbuhan genus Dichapetalum dapat mensintesis asid fluoroasetik terhadap pemangsa. Organisma manusia mempunyai keperluan harian 0.25-0.35 mg.
Penyakit & Gangguan
Walau bagaimanapun, keracunan dan kesihatan yang berkaitan dengan fluorin lebih kerap berlaku. Seperti yang telah disebutkan sebelumnya, fluorin tulen adalah gas kakisan yang sangat beracun. Ini juga yang menyukarkan pembuatan fluorin.
Oleh kerana ia bertindak balas dengan hampir semua bahan, ia juga dapat disimpan dan diangkut dengan sangat teruk. Apabila diracun dengan fluor, luka bakar dan luka bakar kimia berlaku di paru-paru, pada kulit dan di mata. Bergantung pada dosnya, organ-organ yang relevan larut dalam waktu yang singkat, mengakibatkan kematian. Dos mematikan sangat rendah dan 185 ppm. Keracunan fluor dengan fluorin tulen jarang berlaku kerana gas tidak stabil. Walau bagaimanapun, keracunan hidrogen fluorida juga berbahaya. Hidrogen fluorida membentuk ikatan hidrogen dengan protein di dalam badan, di mana struktur tersier protein dimusnahkan. Denaturasi protein badan berlaku.
Fluorida dapat membentuk sebatian kompleks dengan ion aluminium yang mempunyai kesan yang serupa dengan fosfat. Di dalam badan, sebatian ini campur tangan dalam reaksi fosforilasi. Antara lain, ini menyebabkan deregulasi protein G, di mana banyak enzim dihambat. Untuk alasan ini sahaja, peningkatan dos fluorida tidak boleh diterima oleh badan. Mengambil terlalu banyak tablet fluorida juga boleh menyebabkan mual, muntah dan cirit-birit. Fluorida bertindak balas dengan asid perut, di mana sebilangan kecil asid hidrofluorik terbentuk. Ini menyerang membran mukus. Overdosis fluorida yang kronik dan ringan boleh menyebabkan fluorosis.
Fluorosis adalah keracunan fluorin kronik dengan perubahan struktur enamel gigi, batuk, dahak dan sesak nafas. Terlalu banyak hidroksiapatit berubah menjadi fluoroapatit pada gigi. Gigi menjadi lebih rapuh. Tulang juga berubah kerana pembentukan fluorapatit yang berlebihan. Tulang perlahan-lahan mengeras dan merombak. Selain itu, enzim enolase dihambat.



.jpg)
.jpg)