Dehidrogenasease adalah enzim yang terlibat dalam proses pengoksidaan. Mereka berlaku dalam pelbagai varian dalam tubuh manusia dan, sebagai contoh, memangkin pemecahan alkohol di hati.
Apa itu dehidrogenase?
Dehydrogenases adalah enzim khusus. Biokatalis mempercepat pengoksidaan semula jadi substrat. Bahan yang mengoksidakan kehilangan elektron. Dalam tindak balas biologi, dehidrogenase memisahkan anion hidrogen dari substrat. Anion adalah zarah bermuatan negatif.
Dalam kes ini, atom hidrogen menerima elektron dan dengan itu menerima cas elektrik negatif. Tindak balas sebenar berlaku di pusat aktif enzim. Apabila dehidrogenase melepaskan anion hidrogen dari substrat, kofaktor mengambil elektron dan hidrogen. Kofaktor adalah molekul yang berperanan membantu dalam proses enzimatik, tetapi tidak terlibat dalam pembelahan itu sendiri. Kofaktor dehidrogenase merangkumi nikotinamid adenine dinucleotide (NAD +) dan flavin adenine dinucleotide (FAD).
Berbeza dengan dehidrogenase, dehidratase memisahkan seluruh molekul air dari substratnya. Dehydrogenases juga boleh menyebabkan tindak balas balas dan menyumbang kepada pengurangan dan bukannya pengoksidaan. Semasa pengurangan, zarah menerima elektron dan bukannya menyerahkannya. Biologi memberikan dehidrogenase kepada reduktase oksida. Jenis enzim ini wujud di setiap organisma hidup.
Fungsi, kesan & tugas
Dehydrogenases adalah kumpulan yang terdiri daripada banyak enzim khusus. Enzim individu mempunyai tugas yang berbeza dalam tubuh manusia. Biologi membahagikan pelbagai dehidrogenase menjadi subkumpulan yang lebih jauh.
Aldehid dehydrogenases (ALDH), misalnya, membentuk sekumpulan dehidrogenase yang kebanyakannya terdapat di hati. Sebagai peraturan, ALDH hanya bertanggungjawab untuk substrat tertentu dan tidak dapat menyumbang kepada pengoksidaan substrat lain. Contohnya, proses retina ALDH1A1, -1A2 dan -1A3, yang terdapat dalam vitamin A. Walau bagaimanapun, terdapat pengecualian untuk peraturan ini: ALDH2, misalnya, boleh berfungsi dengan substrat yang berbeza dan tidak terhad kepada satu bahan.
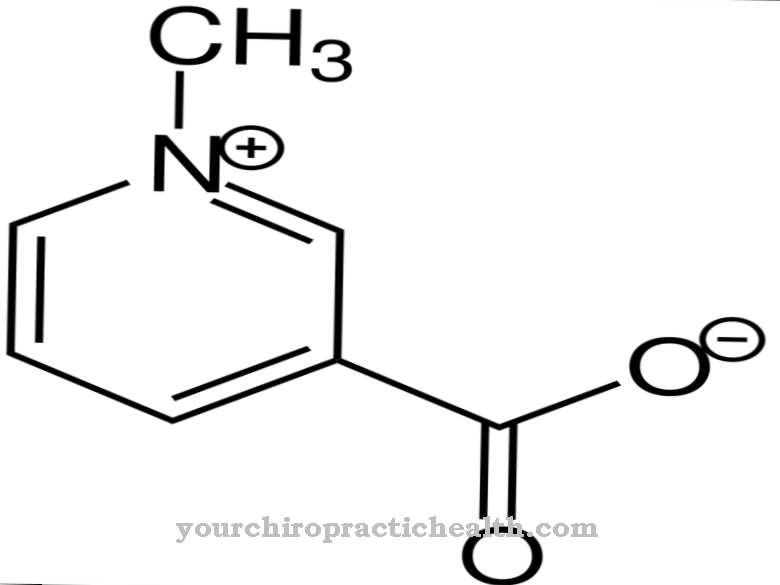
Di hati, dehidrogenase memecah alkohol, misalnya etanol. Mereka membantu membersihkan darah, yang merupakan salah satu tugas hati yang paling penting. Molekul etanol pertama kali menuju ke pusat aktif hidrogenase alkohol (ADH). Dengan bantuan enzim, etanol mengoksidasi dengan memisahkan atom hidrogen bermuatan negatif dan memberikannya kepada kofaktornya NAD +: ADH menukar etanol menjadi asetaldehid dengan cara ini. Acetaldehyde, atau etanal, adalah toksik dan menyebabkan sejumlah penyakit kesihatan.
Makanan biasanya hanya mengandungi sejumlah kecil etanol, yang dapat ditukar oleh tubuh dengan cepat. Oleh itu jumlah etana hanya sedikit. Sebaliknya, asetaldehid adalah substrat untuk ALDH. ALDH memangkinkan penukaran asetaldehid menjadi asid asetik sebelum asid asetik dapat dipisahkan dan dipecah menjadi air dan karbon dioksida. Dalam bentuk ini, molekulnya sama sekali tidak berbahaya.
Pendidikan, kejadian, sifat & nilai optimum
Sebilangan besar dehidrogenase terletak di bahagian cair plasma sel atau di mitokondria. Tubuh wanita menghasilkan kurang ADH daripada badan lelaki. Ini menyumbang kepada fakta bahawa wanita rata-rata lebih sensitif terhadap alkohol.
Nilai tepat dari dehidrogenase berbeza tidak hanya antara kumpulan enzim yang berlainan, tetapi juga antara individu dan kumpulan etnik yang berbeza. Di Asia Timur dan di kalangan penduduk asli Amerika dan Australia, tahap ADH rata-rata lebih rendah daripada, misalnya, di Eropah. Genom manusia mempunyai 19 gen yang diketahui yang menentukan ALDH. Gen ini berada pada kromosom kedua belas. Mereka menentukan urutan asid amino yang manakah dalam rantai protein.
Sifat struktur protein terhasil dari urutan ini. Bentuk dehidrogenase dan dengan demikian fungsi mereka juga bergantung pada urutan asid amino semasa sintesis. Sebagai contoh, ALDH2 terdiri daripada 500 asid amino. Sebagai peraturan, sel mensintesis dehidrogenase, yang kemudian mereka perlukan; Oleh itu, pengangkutan bahan tidak diperlukan.
Penyakit & Gangguan
Apabila alkohol dipecah dalam tubuh manusia, asetaldehid terbentuk sebagai tahap perantaraan. Bahan itu beracun; oleh itu enzim ALDH harus menukarnya menjadi asid asetik secepat mungkin. Dengan jumlah alkohol yang lebih besar, ini biasanya tidak berfungsi sepenuhnya. Oleh itu, mabuk itu berlanjutan beberapa jam selepas minum alkohol.
Perubatan juga memanggilnya Veisalgia. Gejala khasnya adalah sakit kepala, malaise, mual di perut, muntah, dan hilang selera makan. Keupayaan untuk menumpukan perhatian dan bertindak balas sering terhad. Seberapa sensitif orang terhadap alkohol bergantung, antara lain, berapa banyak dehidrogenase yang dihasilkan sel hati. Dehidrogenase juga berperanan dalam pengembangan atau pemeliharaan pelbagai penyakit. Fatty aldehyde dehydrogenase (FALDH), misalnya, memainkan peranan penting dalam perkembangan sindrom Sjogren.
Gejala utama gambaran klinikal adalah keterbelakangan mental dan paraplegia spastik progresif. Paraplegia spastik adalah penyakit neurodegeneratif dan dicirikan oleh kelumpuhan spastik pada kaki. Sindrom Sjögren-Larsson juga bermaksud bahawa lapisan kulit terangsang lebih ketara dan membentuk kepingan kulit yang jelas kelihatan (ichthyosis). Sebagai tambahan kepada ketiga-tiga gejala kardinal ini, gangguan retina adalah perkara biasa. Punca sindrom ini terletak pada gen yang memberi kod untuk FALDH. Kerana adanya mutasi, tubuh tidak mensintesis kompleks enzim dengan FALDH dengan betul. Akibatnya, kepekatan alkohol lemak dan aldehid lemak dalam plasma darah meningkat.


.jpg)

.jpg)
.jpg)